Міністерство охорони здоров’я України
Наказ
16.09.2011 № 595
Про порядок проведення профілактичних щеплень в Україні та контроль якості й обігу медичних імунобіологічних препаратів
Зареєстровано в Міністерстві юстиції України
10 жовтня 2011 р. за № 1159/19897
Відповідно до статті 27 Закону України «Про забезпечення санітарного та епідемічного благополуччя населення», статей 1, 12 та 13 Закону України «Про захист населення від інфекційних хвороб» та Закону України «Про затвердження Загальнодержавної програми імунопрофілактики та захисту населення від інфекційних хвороб на 2009–2015 роки», з метою забезпечення епідемічного благополуччя населення України та попередження інфекцій, керованих засобами специфічної профілактики,
НАКАЗУЮ:
1. Затвердити:
1.1. Календар профілактичних щеплень в Україні (додається).
1.2. Положення про організацію і проведення профілактичних щеплень та туберкулінодіагностики (додається).
1.3. Перелік медичних протипоказань до проведення профілактичних щеплень (додається).
1.4. Інструкцію щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного (додається).
1.5. Положення про оперативне реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку (додається).
1.6. Положення про групу оперативного реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку (додається).
1.7. Порядок відпуску громадянам вакцин та анатоксинів через аптечну мережу (додається).
1.8. Порядок забезпечення належних умов зберігання, транспортування, приймання та обліку вакцин, анатоксинів та алергену туберкульозного в Україні (додається).
2. Міністру охорони здоров’я Автономної Республіки Крим, начальникам управлінь (головних управлінь) охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій, головним державним санітарним лікарям Автономної Республіки Крим, областей, міст Києва та Севастополя, на залізничному, повітряному та водному транспорті забезпечити неухильне проведення на підпорядкованих адміністративних територіях профілактичних щеплень та туберкулінодіагностики відповідно до затверджених цим наказом актів та належний їх облік у закладах охорони здоров’я.
3. Визнати такими, що втратили чинність, накази МОЗ України від 03.02.2006 № 48 «Про порядок проведення профілактичних щеплень в Україні та контроль якості й обігу медичних імунобіологічних препаратів», зареєстрований у Міністерстві юстиції України 02.06.2006 за № 665/12539, від 17.04.2008 № 207 «Про затвердження змін до наказу МОЗ України від 03.02.2006 № 48», зареєстрований у Міністерстві юстиції України 17.05.2008 за № 427/15118, та від 19.05.2011 № 296 «Про внесення змін до наказу МОЗ України від 03.02.2006 № 48», зареєстрований у Міністерстві юстиції України 19.05.2011 за № 601/19339.
4. Управлінню громадського здоров’я та санітарно-епідемічного благополуччя населення Департаменту контролю якості медичних послуг, регуляторної політики та санітарно-епідемічного благополуччя забезпечити подання цього наказу в установленому порядку на державну реєстрацію до Міністерства юстиції України.
5. Цей наказ набирає чинності з дня його офіційного опублікування.
6. Контроль за виконанням цього наказу покласти на першого заступника Міністра Моісеєнко Р. О. та Голову Державної санітарно-епідеміологічної служби України Пономаренка А. М.
Міністр О. В. АНІЩЕНКО
ПОГОДЖЕНО:
Перший заступник Голови Спільного
представницького органу сторони
роботодавців на національному рівні О. МІРОШНИЧЕНКО
За дорученням Першого заступника
керівника Спільного представницького
Органу всеукраїнських профспілок
та профспілкових об’єднань
заступник Голови ФПУ С. Я. УКРАЇНЕЦЬ
Перший заступник Голови —
Голова ліквідаційної комісії Державного
Комітету України з питань регуляторної
політики та підприємництва Г. ЯЦИШИНА
Заступник Голови Державної
служби України з лікарських засобів А. Д. ЗАХАРАШ
Закінчення. Початок – у № 11, 2011; № 1, 2012
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
16.09.2011 № 595
Зареєстровано
в Міністерстві юстиції України
10 жовтня 2011 р.
за № 1161/19899
ПЕРЕЛІК МЕДИЧНИХ ПРОТИПОКАЗАНЬ ДО ПРОВЕДЕННЯ
ПРОФІЛАКТИЧНИХ ЩЕПЛЕНЬ
Вакцини | Протипоказання |
Усі вакцини та анатоксини | Тяжкі ускладнення від попередньої дози у вигляді анафілактичної реакції або токсичної еритеми. Алергічна реакція на будь-який компонент вакцини, анатоксину. Органічні прогресуючі захворювання нервової системи, гідроцефалія та гідроцефальний синдром у ступені декомпенсації, епілепсія, епілептичний синдром із судомами не рідше ніж 2 рази на місяць. Гостре захворювання або загострення хронічного захворювання. Вроджені комбіновані імунодефіцити, первинна гіпогаммаглобулінемія. Імуносупресивна терапія |
Усі живі вакцини | Транзиторна гіпогаммаглобулінемія та злоякісні новоутворення, вагітність, ВІЛ-інфекція (відповідно до глави 3 розділу II Календаря профілактичних щеплень в Україні, затвердженого цим наказом) |
БЦЖ-м | Маса тіла дитини менше 2000 г |
БЦЖ | Маса тіла дитини менше 2500 г |
БЦЖ-м, БЦЖ | Ускладнення на попереднє введення вакцини (лімфаденіт, холодний абсцес, виразка шкіри більше 10 мм у діаметрі, келоїдний рубець, БЦЖ-остит, генералізована БЦЖ-інфекція). Тубінфікування та туберкульоз в анамнезі. Дефекти системи фагоцитозу. Генералізована БЦЖ-інфекція, БЦЖ-остит, виявлені у інших дітей у сім’ї |
ОПВ | ОПВ не вводиться особам з селективним IgA-імунодефіцитом. Особам, яким протипоказано введення живих вакцин, а також членам їхніх родин рекомендовано проведення щеплення інактивованою поліомієлітною вакциною (ІПВ) |
Проти кашлюку | Судоми в анамнезі (вакцинація проводиться АДП або вакциною з ацелюлярним кашлюковим компонентом) |
Жива вакцина проти кору, жива паротитна вакцина, вакцина проти краснухи або тривакцина (кір, паротит, краснуха) | Алергічні реакції на аміноглікозиди. Анафілактичні реакції на яєчний білок. Введення препаратів крові |
1. Основним критерієм при вирішенні питання щодо протипоказань до введення конкретної вакцини є перелік протипоказань, визначений в інструкції про її застосування.
2. Планові вакцинації вакциною, анатоксином відкладаються до закінчення гострих проявів захворювання та загострення хронічних захворювань і проводяться після одужання або під час ремісії хронічного захворювання.
3. Імуносупресивна терапія — терапія, що проводиться цитостатичними препаратами, у тому числі монотерапія циклоспорином A та іншими кортикостероїдами в імуносупресивних дозах, променева терапія. Терапія кортикостероїдами визнається імуносупресивною, якщо з розрахунку на преднізолон складає більше 1 мг/кг/добу та триває більше 14-ти діб за умов системного використання. Планові щеплення інактивованими вакцинами та анатоксинами проводяться після закінчення терапії, щеплення живими вакцинами не раніше ніж через 1 місяць після припинення терапії. Якщо тривалість терапії кортикостероїдами складає менше 14-ти діб незалежно від дози або більше 14-ти діб при дозі за преднізолоном менше 1 мг/кг/добу, або використовується як замісна терапія, або використовується місцево, то така терапія не визнається імуносупресивною та не є протипоказанням до проведення планового щеплення.
4. Після щеплення оральною поліомієлітною вакциною (далі — ОПВ) пропонується обмежити парентеральні втручання протягом 40 діб.
5. Проведення щеплень для профілактики кору, паротиту та краснухи після введення препаратів крові (цільна кров, плазма, препарати імуноглобулінів, еритроцитарна маса), за винятком відмитих еритроцитів, можливе в терміни, що вказані в інструкції про застосування препарату, але не раніше ніж через 3 місяці. Після екстреної профілактики правця протиправцевим людським імуноглобуліном новонародженим вакцинація БЦЖ проводиться за загальноприйнятою схемою. Якщо інтервал між щепленням проти кору, епідемічного паротиту, краснухи та уведенням препарату крові з лікувально-профілактичною метою менше 14-ти днів, щеплення проти цих інфекцій слід повторити.
Рекомендовані інтервали між вакцинацією для профілактики кору,
паротиту, краснухи і вітряної віспи та введенням препаратів крові,
що містять специфічні антитіла
Препарат/показання до застосування препарату | Рекомендований інтервал (місяці) |
Екстрена імунопрофілактика правця імуноглобуліном людини протиправцевим | 3 |
Пасивна імунопрофілактика гепатиту A нормальним імуноглобуліном людини | 3 |
Пасивна імунопрофілактика гепатиту B специфічним імуноглобуліном проти гепатиту B | 3 |
Пасивна імунопрофілактика кору нормальним імуноглобуліном людини | 5 |
стандартна контактному (без імунодефіциту) з імунодефіцитом | 6 |
Трансфузія крові; |
|
відмиті еритроцити; | – |
еритроцити з додаванням консерванту (adenine saline); | 6 |
цільна кров (Ht 65%); | 6 |
цільна кров (Ht 35–50%); | 6 |
плазма/тромбоцити | 7 |
Імуноглобулін протицитомегаловірусний в/в | 6 |
В/в імуноглобулін; |
|
сепсис; | 8 |
тромбоцитопенічна пурпура; | 10 |
хвороба Кавасакі | 11 |
Директор Департаменту охорони
материнства, дитинства та
санаторного забезпечення С. І. ОСТАШКО
Начальник Управління громадського
здоров’я та санітарно-епідемічного
благополуччя населення А. А. ГРИГОРЕНКО
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
16.09.2011 № 595
Зареєстровано
в Міністерстві юстиції України
10 жовтня 2011 р.
за № 1162/19900
Інструкція щодо організації епідеміологічного нагляду
за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного
I. Загальні положення
1. Ця Інструкція визначає порядок проведення епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного.
2. Вимоги цієї Інструкції є обов’язковими для закладів охорони здоров’я України незалежно від форм власності та відомчої належності.
3. Моніторинг за несприятливими подіями після імунізації або туберкулінодіагностики — це система постійного спостереження за безпекою вакцин, анатоксинів та алергену туберкульозного в умовах їх практичного використання.
Несприятливі події після імунізації (далі — НППІ) — усі захворювання, які зареєстровані у щепленого протягом післявакцинального періоду. До НППІ належать: ускладнений перебіг післявакцинального періоду та післявакцинальні реакції і ускладнення.
Післявакцинальні реакції (далі — реакції) — це клінічні ознаки нестійких патологічних (функціональних) змін в організмі, що виникають у зв’язку з проведенням щеплення.
Післявакцинальні ускладнення (далі — ускладнення) — це стійкі функціональні та морфологічні зміни в організмі, що виходять за межі фізіологічних коливань і призводять до значних порушень у стані здоров’я.
Післявакцинальний період — 30 діб після проведеного щеплення, крім вакцин для профілактики туберкульозу (БЦЖ, БЦЖ-м), оральної поліомієлітної вакцини (ОПВ) та вакцин, які містять паротитний компонент, для яких післявакцинальний період визначається відповідно до інструкції про застосування вакцини.
Ускладнений перебіг післявакцинального періоду — виникнення гострого або загострення хронічного захворювання у післявакцинальному періоді, яке за часом збігається з введенням вакцини та не має зв’язку із щепленням.
Місцеві реакції — клінічні ознаки, які проявляються безпосередньо у місці введення вакцини, анатоксину та алергену туберкульозного.
Сильна місцева реакція характеризується клінічними ознаками — набряком м’яких тканин понад 50 мм у діаметрі, інфільтратом понад 20 мм, гіперемією понад 80 мм у діаметрі.
Загальні реакції — нестійкі клінічні ознаки, які проявляються в певні строки після введення імунобіологічного препарату (вакцини, анатоксину або алергену туберкульозного) та призводять до короткочасних функціональних змін в організмі.
До сильної загальної реакції належить підвищення температури тіла ≥39 °C.
Групові реакції — два або більше випадків, які мають схожі клінічні ознаки, пов’язані за часом, місцем проведення щеплення та видом введеної вакцини, анатоксину, алергену туберкульозного.
4. Для діагностики і обліку реакцій та ускладнень використовують чотири методи: клінічний, лабораторний, епідеміологічний і статистичний.
Клінічний і лабораторний методи є основними при встановленні діагнозу у післявакцинальному періоді. Ці методи дають змогу відрізняти реакції від ускладнень та ускладненого перебігу післявакцинального періоду.
II. Виявлення НППІ і реєстрація реакцій та ускладнень
1. Особи, які підлягають щепленням (або їхні батьки чи інші законні представники), повинні бути проінформовані медичними працівниками про можливі реакції або ускладнення після застосування певної вакцини, анатоксину, алергену туберкульозного.
2. Виявлення НППІ здійснюють на всіх рівнях медичного обслуговування і спостереження:
- медичні працівники, що проводять щеплення;
- медичні працівники, що проводять лікування в медичних закладах;
- батьки або законні представники, попередньо проінформовані про можливі реакції або ускладнення після застосування певної вакцини, анатоксину, алергену туберкульозного.
3. Лікарі усіх закладів охорони здоров’я незалежно від підпорядкування та форм власності зобов’язані фіксувати інформацію про реакції у картціпо-відомленні про побічну реакцію чи відсутність ефективності лікарського засобу при медичному застосуванні за формою № 137/0, наведеній у додатку 1 до Порядку здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування, затвердженого наказом МОЗ України від 27.12.2006 № 898, зареєстрованого у Міністерстві юстиції України 29.01.2007 за № 73/13340.
4. Реєстрації з відповідним записом у формах первинної медичної документації: «Історії розвитку дитини» — форма № 112/о, затвердженій наказом МОЗ України від 27.12.99 № 302 (далі — форма № 112/о), «Медичній карті амбулаторного хворого» — форма № 025/о, затвердженій наказом МОЗ України від 27.12.99 № 302 (далі — форма № 025/о), «Медичній карті стаціонарного хворого» — форма № 003/о, затвердженій наказом МОЗ України від 26.07.99 № 184 (далі — форма № 003/о), та «Карті профілактичних щеплень» — форма № 063/о, затвердженій наказом МОЗ України від 10.01.2006 № 1, зареєстрованим у Міністерстві юстиції України 08.06.2006 за № 686/12560 (далі — форма № 063/о), підлягають усі випадки реакцій та ускладнень відповідно до Переліку можливих несприятливих подій після імунізації, що потребують подальшого розслідування, наведеного у додатку 1 до цієї Інструкції, та Строків розвитку можливих несприятливих подій після імунізації (реакцій та ускладнень), наведених у додатку 2 до цієї Інструкції, а також:
- летальні випадки, що трапляються протягом 30-ти діб після щеплення;
- випадки госпіталізації протягом 30-ти діб після щеплення.
5. Лікувально-профілактичні заклади (далі — ЛПЗ), що проводять щеплення, здійснюють облік реакцій, ускладнень та 1 раз на місяць подають узагальнені дані до територіальних СЕС згідно з додатком 3 до цієї Інструкції. У разі відсутності за звітний період реакцій та ускладнень мають бути зазначені «нулі» у відповідних графах.
Територіальні СЕС — це санітарно-епідеміологічні заклади Держсанепідемслужби в Автономній Республіці Крим, областях, у містах, районах, на водному, залізничному та повітряному транспорті, об’єктах з особливим режимом роботи.
Подача інформації про реєстрацію випадків реакцій та ускладнень здійснюється згідно з кодами можливих НППІ та строків їх розвитку (додатки 1, 2) для вакцин, анатоксинів та алергену туберкульозного здійснюється відповідно до додатка 3 до цієї Інструкції.
Форму узагальнених даних про наявність НППІ (реакцій та ускладнень) заповнюють лікарі ЛПЗ та територіальних СЕС. При заповненні узагальнених даних обов’язково вказуються заклад охорони здоров’я (ЛПЗ, територіальна СЕС) та період, за який надається інформація (перше півріччя та рік). Після заголовка обов’язково має бути вказана дата заповнення узагальнених даних.
Заповнювати узагальнені дані необхідно на кожну окрему серію застосованої вакцини, анатоксину та алергену туберкульозного. При цьому треба вказувати торговельну назву, найменування підприємства виробника, кількість введених доз.
Зареєстровані реакції або ускладнення слід заносити до узагальнених даних згідно з кодами можливих НППІ. За наявності клінічної ознаки реакції або ускладнення відповідно до коду можливих НППІ вказується кількість реакцій або ускладнень, при їх відсутності проставляються нулі.
До узагальнених даних входить кількість групових реакцій та ускладнень, які розслідувалися комісією, створеною управліннями охорони здоров’я областей, міст Києва та Севастополя або Міністерством охорони здоров’я Автономної Республіки Крим, а також кількість ускладнень, які розслідувалися групами оперативного реагування (головною, регіональною).
Подача узагальнених даних відбувається в такі строки: з ЛПЗ до СЕС міського та районного рівнів за один місяць; до СЕС обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті за один місяць; з СЕС обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті до Департаменту імунобіологічних препаратів та імунопрофілактики державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» (далі — Департамент імунобіологічних препаратів та імунопрофілактики) за шість місяців та за один рік.
6. Відповідальним за облік та надання інформації про реакції і ускладнення є керівник ЛПЗ, що проводить щеплення.
7. Повідомлення про групові реакції або ускладнення мають бути передані з ЛПЗ до СЕС (міського або районного рівнів), потім до СЕС обласного, республіканського, міського (міст Києва та Севастополя) рівнів та СЕС на водному, залізничному, повітряному транспорті протягом 24 годин після їх виявлення.
8. Територіальні СЕС (обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті) інформують обласні, міські управління охорони здоров’я або Міністерство охорони здоров’я Автономної Республіки Крим про випадки групових реакцій або ускладнень (крім госпіталізації та летальних випадків) не пізніше ніж протягом 24-х годин після їх отримання.
9. Для розслідування групових реакцій або ускладнень (крім госпіталізації та летальних випадків) обласними та міськими управліннями охорони здоров’я або Міністерством охорони здоров’я Автономної Республіки Крим створюється комісія, до складу якої входять: педіатр, терапевт, епідеміолог, імунолог, невролог дитячий/дорослий (за згодою), алерголог дитячий/дорослий (за згодою), фтизіопедіатр (за згодою). Комісія не пізніше ніж протягом 48-ми годин з початку виникнення групових реакцій або ускладнень (крім госпіталізації та летальних випадків) розпочинає розслідування (епідеміологічне та клінічне).
10. Матеріали розслідування групових реакцій та ускладнень (крім госпіталізації та летальних випадків) подаються територіальними СЕС у 3-денний строк з моменту реєстрації згідно з формою подачі інформації про випадок несприятливої події після імунізації (групові реакції та ускладнення) при використанні вакцин, анатоксинів та алергену туберкульозного, наведеною у додатку 4 до цієї Інструкції, до Департаменту імунобіологічних препаратів та імунопрофілактики.
11. СЕС міського та районного рівнів дані результатів обліку реакцій та ускладнень з ЛПЗ, що проводять щеплення, надають до СЕС (обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті) один раз на місяць. СЕС обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті узагальнюють дані обліку реакцій і ускладнень за I півріччя та за рік і надають їх Департаменту імунобіологічних препаратів та імунопрофілактики до 5 серпня поточного року та 5 лютого наступного року згідно з додатком 3 до цієї Інструкції. За відсутності НППІ у відповідних графах проставляються «нулі».
12. Департамент імунобіологічних препаратів та імунопрофілактики узагальнює отримані дані реакцій і ускладнень за I півріччя і за рік та інформує епідеміологічні відділи СЕС обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті про результати моніторингу вакцин, анатоксинів, алергену туберкульозного за звітний період.
13. Епідеміологічні відділи територіальних СЕС усіх рівнів разом з місцевими управліннями охорони здоров’я зобов’язані інформувати ЛПЗ про результати моніторингу вакцин, анатоксинів, алергену туберкульозного за звітний період.
14. У разі госпіталізації або летального випадку у післявакцинальному періоді розслідування проводиться групами оперативного реагування відповідно до Положення про групу оперативного реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку, затвердженого цим наказом.
III. Аналіз інформації про НППІ
1. Аналіз моніторингу за НППІ в Україні здійснює Департамент імунобіологічних препаратів та імунопрофілактики.
2. Департамент імунобіологічних препаратів та імунопрофілактики проводить моніторинг щодо повноти виявлення, реєстрації реакцій та ускладнень, а також бере участь у розслідуванні НППІ.
3. Департамент імунобіологічних препаратів та імунопрофілактики подає до Управління громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України (далі — Управління) звіт за результатами моніторингу реакцій і ускладнень (до 20 вересня — за півріччя, до 20 березня наступного року — за рік).
4. Департамент імунобіологічних препаратів та імунопрофілактики подає оперативну інформацію про випадки групових реакцій, випадки госпіталізації, летальні випадки, які можуть бути пов’язані із щепленням, до Управління для вирішення питання про подальше застосування вакцини, анатоксину та алергену туберкульозного конкретного виробника.
5. Департамент імунобіологічних препаратів та імунопрофілактики інформує Управління про необхідність призупинення використання конкретної серії вакцини, анатоксину, алергену туберкульозного в регіоні, звідки отримано повідомлення про випадки групових реакцій та ускладнень, госпіталізації, про летальні випадки, які можуть бути пов’язані із щепленням, або в Україні, якщо вони отримані з кількох регіонів, з подальшим вирішенням протягом не більше ніж двох місяців можливості та/або доцільності подальшого застосування конкретної серії вакцини в медичній практиці в Україні.
IV. Аналіз епідеміологічної ефективності вакцин, анатоксинів
1. Департамент імунобіологічних препаратів та імунопрофілактики здійснює моніторинг щодо реєстрації випадків інфекційного захворювання у осіб, які раніше були щеплені проти відповідної інфекції.
2. Лікар-епідеміолог територіальної СЕС, отримавши повідомлення про інфекційне захворювання, проводить епідеміологічне розслідування на місці. Якщо під час епідеміологічного розслідування з’ясовується, що має місце випадок інфекційного захворювання у щепленого, Лікар-епідеміолог заповнює Повідомлення про захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики, у щеплених, затверджене наказом МОЗ України від 17.01.2008 № 19.
Один раз на місяць СЕС міського та районного рівнів подає інформацію до СЕС обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті, заповнюючи Карту епідрозслідування захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики, у щеплених, затверджену наказом МОЗ України від 17.01.2008 № 19, на кожен випадок інфекційного захворювання.
3. Епідеміологічні відділи СЕС обласного, республіканського рівнів, міст Києва, Севастополя та СЕС на водному, залізничному, повітряному транспорті узагальнюють отриману інформацію та один раз на рік надають інформацію про випадки інфекційного захворювання серед раніше щеплених осіб до Департаменту імунобіологічних препаратів та імунопрофілактики не пізніше 5 лютого наступного року разом з річними звітами про післявакцинальні реакції та ускладнення.
Загальний звіт по картах епідрозслідування захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики, у щеплених, форма якого затверджена наказом МОЗ України від 17.01.2008 № 19, подається факсом або на електронному носії.
4. Аналіз інформації відносно епідеміологічної ефективності вакцин та анатоксинів в Україні здійснює Департамент імунобіологічних препаратів та імунопрофілактики.
5. Департамент імунобіологічних препаратів та імунопрофілактики подає до Управління загальний звіт по картах епідрозслідування захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики, у щеплених, форма якого затверджена наказом МОЗ України від 17.01.2008 № 19, за звітний період (до 20-го березня наступного року).
Директор Департаменту охорони
материнства, дитинства та
санаторного забезпечення С. І. ОСТАШКО
Начальник Управління громадського
здоров’я та санітарно-епідемічного
благополуччя населення А. А. ГРИГОРЕНКО
Додаток 1
до Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного
Перелік можливих несприятливих подій після імунізації,
що потребують подальшого розслідування
Коди | Можливі несприятливі події після імунізації |
I. Реакції |
|
1 | Підвищення температури до 39 °C1 |
2 | Підвищення температури більше 39 °C (сильна загальна реакція організму) |
3 | Біль, набряк м’яких тканин більше 50 мм, гіперемія у місці введення більше 80 мм, інфільтрат більше 20 мм (сильна місцева) |
4 | Лімфоаденопатія |
5 | Головний біль |
6 | Дратівливість, порушення сну |
7 | Висипання неалергічного генезу |
8 | Нудота, біль у животі, диспепсія, діарея |
9 | Катаральні явища |
10 | Міалгія, артралгія |
11 | Транзиторна тромбоцитопенія |
II. Ускладнення |
|
12 | Післяін’єкційний абсцес |
13 | Анафілактичний шок та анафілактоїдні реакції |
14 | Алергічні реакції (набряк Квінке, висипка за типом кропивниці, синдром Стівенса-Джонсона, Лайєла) |
15 | Фебрильні судоми |
16 | Афебрильні судоми |
17 | Підшкірний холодний абсцес |
18 | Поверхнева виразка >10 мм |
19 | Регіональний(і) лімфаденіт(и) |
20 | Келоїдний рубець |
21 | Генералізована БЦЖ-інфекція, остеомієліт, остеїт |
____________
1 Залежно від індивідуальних особливостей дитини.
Додаток 2
до Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного
Строки розвитку можливих несприятливих подій після імунізації
(реакцій та ускладнень)
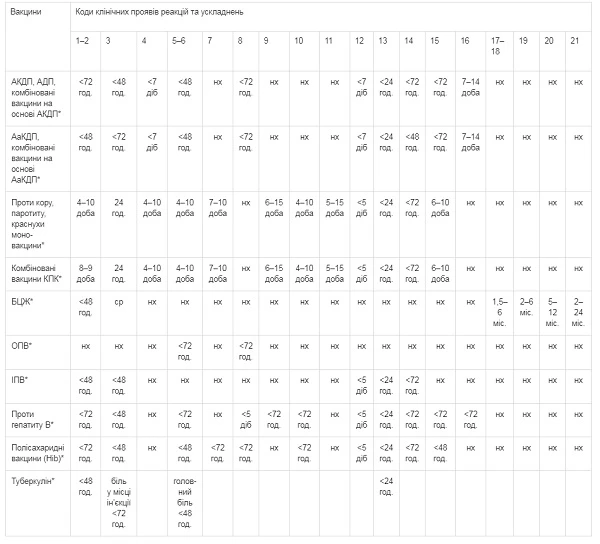
____________
*
Перелік не є вичерпним, необхідно користуватися інструкцією про використання окремих вакцин, анатоксинів та алергенів туберкульозних, зареєстрованих в Україні;
нх — не характерно;
ср — специфічна реакція на введення вакцини БЦЖ.
Додаток 3
до Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного
Узагальнені дані про наявність НППІ (реакцій та ускладнень)
у ___ (ЛПЗ, територіальні СЕС) за ___ період
Торго-вельна назва | Найменування підприємства виробника | Серія | Кількість введених доз | Реакції (згідно з кодами | Ускладнення (згідно з кодами можливих НППІ)* | ||||
код | НППІ | кількість | код | НППІ | кіль-кість | ||||
|
|
|
| 1 | Підвищення температури |
| 12 | Післяін’єкційний абсцес |
|
|
|
|
| 2 | Підвищення температури = 39 °C |
| 13 | Анафілактичний шок |
|
|
|
|
| 3 | Біль |
|
| Анафілактоїдна реакція |
|
|
|
|
|
| Набряк м’яких тканин = 50 мм |
| 14 | Алергічні реакції: |
|
|
|
|
|
| Гіперемія у місці введення = 80 мм |
|
| Набряк Квінке |
|
|
|
|
|
| Інфільтрат = 20 мм |
|
| Висипка за типом кропивниці |
|
|
|
|
|
| Набряк м’яких тканин |
|
| Синдром Стівенса-Джонсона |
|
|
|
|
|
| Гіперемія у місці введення |
|
| Синдром Лайєла |
|
|
|
|
|
| Інфільтрат |
| 15 | Фебрильні судоми |
|
|
|
|
| 4 | Лімфоаденопатія |
| 16 | Судоми |
|
|
|
|
| 5 | Головний біль |
| 17 | Підшкірний |
|
|
|
|
| 6 | Дратівливість |
| 18 | Поверхнева |
|
|
|
|
|
| Порушення сну |
| 19 | Регіональний(і) лімфаденіт(и) = =10 мм |
|
|
|
|
| 7 | Висипання неалергічного генезу |
| 20 | Келоїдний рубець |
|
|
|
|
| 8 | Нудота |
| 21 | Генералізована БЦЖ-інфекція |
|
|
|
|
|
| Біль у животі |
|
| Остеомієліт |
|
|
|
|
|
| Диспепсія |
|
| Остеїт |
|
|
|
|
|
| Діарея |
|
|
|
|
|
|
|
| 9 | Катаральні явища |
|
|
|
|
|
|
|
| 10 | Міалгія, артралгія |
|
|
|
|
|
|
|
| 11 | Транзиторна тромбоцитопенія |
|
|
|
|
____________
*
Перелік не є вичерпним, необхідно користуватися інструкцією про використання окремих вакцин, анатоксинів та алергенів туберкульозних, зареєстрованих в Україні.
Додаток 4
до Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного
Перелік інформації про випадок несприятливої події
після імунізації (групові реакції та ускладнення) при використанні
вакцин, анатоксинів та алергену туберкульозного
1. Прізвище, ім’я, по батькові особи, що щеплюється. Дата народження. (У разі надання згоди на збір та обробку персональних даних).
2. Установа, що розслідувала (виявила) випадок несприятливої події після імунізації (далі — НППІ) після застосування вакцини, анатоксину, алергену туберкульозного.
3. Відомості про вакцину, анатоксин, алерген туберкульозний: торговельна назва, серія, термін придатності, найменування підприємства-виробника, кількість отриманих доз, дата отримання, умови та температурний режим транспортування і зберігання в області, районі, місці застосування.
Порушення процедури вакцинації (методу введення, дозування, умов зберігання, із розкритої ампули).
Кількість осіб, щеплених даною серією в районі, області, або кількість використаних доз вакцини, анатоксину або алергену туберкульозного.
Наявність на дану серію вакцини, анатоксину або алергену туберкульозного реакцій або ускладнень.
4. Відомості про стан здоров’я особи (у разі групової реакції інформація надається на кожну особу).
Дата вакцинації або постановки проби Манту. Огляд лікаря. Температура перед вакцинацією.
Особливості здоров’я (недоношеність, родова травма, черепно-мозкова травма, терапія кортикостероїдами, яка передувала щепленню).
Перенесені захворювання (для дітей перших 3 років життя із зазначенням дати та тривалості хвороби); указати дату та тривалість останнього захворювання.
Захворювання алергічного характеру (на лікарські препарати та харчові продукти).
Наявність судом в анамнезі щепленого, його батьків, братів і сестер, при підвищеній температурі або без неї, як давно.
Проведені щеплення із зазначенням дат введення вакцин, анатоксинів.
Чи спостерігались НППІ у вакцинованого на попередні щеплення (які, їх характер).
Додаткові дані (контакт з інфекційними хворими в родині, дитячому закладі, переохолодження).
5. Клінічний перебіг.
Дата захворювання, скарги. Дата звернення. Клінічні симптоми. Перебіг захворювання (стисло). Додаткова інформація, яка сприятиме встановленню причинно-наслідкового зв’язку з введенням вакцини, анатоксину, алергену туберкульозного. Остаточний діагноз.
Після щеплення вакциною БЦЖ, БЦЖ-м необхідно вказати зміни у місці введення (виразка, абсцес, рубчик, келоїдний рубець — їх розміри в мм).
Стан регіональних лімфовузлів (при їх збільшенні — локалізацію, розмір у мм).
У разі проведення хірургічного лікування — результати гістологічного дослідження.
6. Висновок комісії з розслідування НППІ, яка створена обласними, міськими управліннями охорони здоров’я, міст Києва та Севастополя або МОЗ Автономної Республіки Крим, про причини ускладнення.
Посади та підписи членів комісії, яка створена обласними, міськими управліннями охорони здоров’я, міст Києва та Севастополя або МОЗ Автономної Республіки Крим.
Дата.
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
16.09.2011 № 595
Зареєстровано
в Міністерстві юстиції України
10 жовтня 2011 р.
за № 1163/19901
Положення про оперативне реагування на несприятливі події
після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку
1. Це Положення регулює порядок оперативного реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку.
2. Центральна група оперативного реагування створюється при Міністерстві охорони здоров’я України та складається з головних спеціалістів Міністерства охорони здоров’я України і профільних спеціалістів, які залучаються у разі потреби.
3. Регіональні групи оперативного реагування створюються при Міністерстві охорони здоров’я Автономної Республіки Крим, управліннях охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій із залученням профільних спеціалістів.
4. Профільні спеціалісти, які повинні входити до центральної та регіональної груп оперативного реагування: судово-медичний експерт, патологоанатом, терапевт, педіатр, невролог (дитячий невролог), інфекціоніст (дитячий інфекціоніст), алерголог (дитячий алерголог), імунолог (дитячий імунолог), анестезіолог (дитячий анестезіолог).
5. Кожен випадок порушення у стані здоров’я, що виникає у післявакцинальному періоді при застосуванні вакцин, анатоксинів та алергену туберкульозного, підлягає розслідуванню (у разі госпіталізації або летального випадку протягом 30 діб).
6. З метою оперативного реагування на кожен випадок, який потребує надання невідкладної медичної допомоги та госпіталізації у післявакцинальному періоді, лікарі закладів охорони здоров’я всіх форм власності повинні обов’язково при зборі анамнезу життя з’ясувати, чи було проведено щеплення протягом останніх 30 діб. Якщо так, то якою вакциною. Врахувати клінічні події та строки їх виникнення. Це допоможе лікарю лікувально-профілактичного закладу провести диференційний аналіз між патологічним станом, який збігся за часом з проведенням щеплення, з можливими післявакцинальними реакціями або ускладненнями.
7. У разі госпіталізації або летального випадку в післявакцинальному періоді після застосування вакцин, анатоксинів та алергену туберкульозного інформація надається:
7.1. Керівником лікувально-профілактичного закладу, куди була госпіталізована дитина або доросла особа з підозрою на ускладнення після застосування вакцин, анатоксинів, алергену туберкульозного, та у разі летального випадку у післявакцинальному періоді протягом 24 годин від моменту виявлення таких випадків — територіальній СЕС, Управлінню громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України, Департаменту імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України» згідно з додатком 1 до цього Положення.
8. Департамент імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України» інформує голову групи оперативного реагування (регіональної або центральної) щодо проведення розслідування даного випадку.
У разі якщо за попередньою оцінкою зв’язок ускладнення або летальний випадок у післявакцинальному періоді з введенням вакцин, анатоксинів та алергену туберкульозного вірогідний/можливий, то для розслідування визначається центральна група оперативного реагування. У разі малоймовірного зв’язку — регіональна.
9. Голова групи оперативного реагування залежно від клінічних проявів випадку підозри на ускладнення або попереднього патолого-анатомічного діагнозу летального випадку в післявакцинальному періоді формує склад групи оперативного реагування (регіональної або центральної) протягом 24-х годин.
10. Група оперативного реагування (центральна або регіональна) повинна прибути на місце розслідування не пізніше ніж протягом 24-х годин після отримання інформації.
11. Попередня довідка за результатами розслідування групою оперативного реагування (центральною або регіональною) надається протягом 24-х годин після закінчення розслідування Управлінню громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України та Департаменту імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України».
12. Заключний висновок груп оперативного реагування щодо розслідування несприятливої події після імунізації (додаток 2) надається до Управління громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України та Департаменту імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України» протягом 30 днів з моменту реєстрації несприятливої події після імунізації.
Директор Департаменту охорони
материнства, дитинства
та санаторного забезпечення С. І. ОСТАШКО
Начальник Управління громадського
здоров’я та санітарно-епідемічного
благополуччя населення А. А. ГРИГОРЕНКО
Додаток 1
до Положення про оперативне реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку
Оперативне повідомлення про несприятливі події після імунізації
1 | Прізвище, ім’я, по батькові щепленого (у разі надання згоди на збір та обробку персональних даних) |
|
2 | Дата народження |
|
3 | Місце проживання |
|
4 | Найменування закладу охорони здоров’я, що подав інформацію про несприятливі події після імунізації |
|
5 | Контактний телефон керівника закладу охорони здоров’я, де виявлено несприятливі події після імунізації |
|
6 | Торговельна назва вакцини, анатоксину або алергену туберкульозного |
|
7 | Найменування виробника вакцини, анатоксину або алергену туберкульозного |
|
8 | Серія вакцини, анатоксину або алергену туберкульозного |
|
9 | Дата вакцинації |
|
10 | Дата початку клінічних симптомів |
|
11 | Характеристика клінічних симптомів |
|
12 | Попередній діагноз |
|
13 | Дата смерті (у разі летального випадку) |
|
14 | Прізвище, ім’я, по батькові особи, яка заповнювала повідомлення, дата, час |
|
Додаток 2
до Положення про оперативне реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку
Заключний висновок груп оперативного реагування
щодо розслідування несприятливої події після імунізації
I. Дані про особу
1. Прізвище, ім’я, по батькові щепленого (у разі надання згоди на збір та обробку персональних даних).
2. Місце проживання.
II. Відомості про вакцину, анатоксин та алерген туберкульозний
1. Торговельна назва, серія, найменування виробника вакцини, анатоксину або алергену туберкульозного.
2. Умови та температурний режим зберігання при транспортуванні.
3. Проведення процедури вакцинації (метод введення, доза, умови зберігання відкритої ампули (флакона)).
4. Кількість використаних доз даної серії вакцини, анатоксину та алергену туберкульозного на відповідній адміністративній території та наявність несприятливих подій після імунізації або туберкулінодіагностики.
III. Відомості про стан здоров’я щепленого
1. Наявність медичного огляду перед щепленням.
2. Дотримання медичних показань та протипоказань перед щепленням або туберкулінодіагностикою.
3. Анамнез життя:
- неврологічний анамнез;
- алергологічний анамнез;
- спадкові захворювання.
4. Дата введення, серія, найменування виробника вакцини, анатоксину або алергену туберкульозного, наявність реакцій на щеплення.
5. Анамнез перенесених захворювань.
6. Епідеміологічне оточення.
IV. Клінічний перебіг
1. Дата клінічних проявів несприятливих подій після імунізації (на яку добу після щеплення).
2. Дата звернення за медичною допомогою.
3. Скарги при перших клінічних проявах несприятливих подій після імунізації.
V. Заключний діагноз
1. Основний.
2. Супутні захворювання.
VI. Результати лабораторних досліджень
1. Показники лабораторних досліджень.
2. Результати інструментальних досліджень.
VII. У разі летального випадку
1. Дата смерті.
2. Патолого-анатомічний діагноз з результатами гістологічних, вірусологічних, бактеріологічних, токсикологічних досліджень.
VIII. Висновок із зазначенням причини розвитку несприятливої події після імунізації
1. Висновок із зазначенням причини розвитку несприятливої події після імунізації з проведеним щепленням чи туберкулінодіагностикою.
2. Посади та підписи членів регіональних або центральних груп оперативного реагування.
3. Дата.
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
16.09.2011 № 595
Зареєстровано
в Міністерстві юстиції України
10 жовтня 2011 р.
за № 1164/19902
Положення про групу оперативного реагування
на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації
або летального випадку
1. Це Положення визначає порядок створення, склад, завдання груп оперативного реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного (далі — група оперативного реагування) у разі госпіталізації або летального випадку.
2. Склад центральної групи оперативного реагування затверджується наказом МОЗ України. Склад регіональних груп оперативного реагування затверджується наказами Міністерства охорони здоров’я Автономної Республіки Крим, управлінь охорони здоров’я обласних, Київської та Севастопольської міських державних адміністрацій.
3. Група оперативного реагування залучається до дій Управлінням громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України із залученням Департаменту імунобіологічних препаратів та імунопрофілактики державного підприємства «Державний експертний центр Міністерства охорони здоров’я України». Під час виконання завдань за призначенням у регіоні, де було зареєстровано виникнення випадку несприятливої події після імунізації, у разі госпіталізації або летального випадку група оперативного реагування підпорядковується безпосередньо керівнику лікувально-профілактичного закладу, де зафіксовано несприятливу подію після імунізації.
4. Група оперативного реагування у своїй діяльності керується цим Положенням та іншими чинними нормативно-правовими актами у сфері охорони здоров’я.
5. Склад групи формується залежно від клінічних проявів на несприятливі події після імунізації та складності випадку після застосування вакцин, анатоксинів та алергену туберкульозного.
6. Склад групи оперативного реагування може бути змінений головою групи залежно від несприятливої події після імунізації та обставин, які склалися у разі госпіталізації або летального випадку після застосування вакцин, анатоксинів та алергену туберкульозного.
7. Групу оперативного реагування очолює голова, який має спеціальність лікар-педіатр або лікар-терапевт.
8. Збір, аналіз, узагальнення та оцінка первинної інформації про випадок госпіталізації або летальний випадок після застосування вакцин, анатоксинів та алергену туберкульозного.
9. Надання консультативної допомоги у разі порушення стану здоров’я особи в післявакцинальному періоді.
10. Проведення експертної оцінки первинної медичної документації випадку, яка передбачає:
- оцінку якості надання медичної допомоги відповідно до вимог клінічних протоколів та стандартів надання медичної допомоги;
- встановлення причинно-наслідкового зв’язку клінічних проявів несприятливих подій після імунізації із застосуванням вакцин, анатоксинів та алергену туберкульозного;
- виявлення можливих недоліків на всіх етапах надання медичної допомоги;
- рекомендації щодо прийняття відповідних організаційних рішень з метою попередження подібних випадків у майбутньому.
11. Постійне інформування Управління громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України і Департаменту імунобіологічних препаратів та імунопрофілактики державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» про хід розслідування з місця виникнення випадку несприятливої події після імунізації після застосування вакцин, анатоксинів та алергену туберкульозного.
12. Підготовка заключного висновку щодо розслідування несприятливої події після імунізації.
13. Інформація про розслідування випадку несприятливої події після імунізації подається в заключному висновку.
14. Висновок підписують члени групи оперативного реагування (центральної або регіональної) у трьох примірниках. Один примірник надається керівнику управління охорони здоров’я відповідної території; другий — Управлінню громадського здоров’я та санітарно-епідемічного благополуччя населення МОЗ України; третій — Департаменту імунобіологічних препаратів та імунопрофілактики державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» (на паперових та електронних носіях).
Директор Департаменту охорони
материнства, дитинства та
санаторного забезпечення С. І. ОСТАШКО
Начальник Управління громадського
здоров’я та санітарно-епідемічного
благополуччя населення А. А. ГРИГОРЕНКО
ЗАТВЕРДЖЕНО
Наказ Міністерства
охорони здоров’я України
16.09.2011 № 595
Зареєстровано
в Міністерстві юстиції України
10 жовтня 2011 р.
за № 1165/19903
Порядок відпуску громадянам вакцин та анатоксинів
через аптечну мережу
I. Загальні положення
1. Цей Порядок регулює механізм відпуску вакцин та анатоксинів громадянам через аптечну мережу.
2. Надходження, зберігання вакцин та анатоксинів в аптечних закладах та закладах охорони здоров’я, продаж їх громадянам повинні здійснюватись з дотриманням «холодового ланцюга», що забезпечує зберігання первинної якості препаратів.
3. До реалізації через аптечну мережу дозволяються вакцини та анатоксини як імпортного, так і вітчизняного виробництва. Усі вакцини повинні бути зареєстровані в Україні і мати висновок про відповідність медичного імунобіологічного препарату показникам якості, виданий МОЗ України на кожну серію вакцини та анатоксину, наведений у додатку 2 до Порядку здійснення державного контролю за якістю медичних імунобіологічних препаратів, які використовуються, виробляються або пропонуються до застосування в медичній практиці в Україні, затвердженого наказом МОЗ України від 06.12.2001 № 486, зареєстрованого в Міністерстві юстиції України 28.02.2002 за № 205/6493. Окрім того, такі вакцини та анатоксини повинні мати етикетку, пакування та інструкцію щодо застосування українською мовою.
4. Керівник аптечного закладу призначає відповідального за доставку, облік, зберігання, продаж та утилізацію вакцин та анатоксинів.
5. Відпуск вакцин та анатоксинів дозволяється за наявності рецепта лікаря (форма № 1, наведена у додатку 1 до Правил виписування рецептів та вимог-замовлень на лікарські засоби і вироби медичного призначення, затверджених наказом МОЗ України від 19.07.2005 № 360, зареєстрованих у Міністерстві юстиції України 20.07.2005 за № 782/11062). При реалізації вакцин відповідальна особа вказує в рецепті лікаря дату та час відпуску. Здійснення імунізації вакцинами, які були придбані через аптечну мережу, дозволяється тільки за наявності розрахункового документа, в якому зазначені дата та час відпуску вакцини, анатоксину.
6. У цьому Порядку терміни вживаються в такому значенні:
- вакцини та анатоксини — один із видів медичних імунобіологічних препаратів, призначений для імунопрофілактики інфекційних захворювань.
- Вакцини та анатоксини, що містять один компонент, називаються моновакцинами.
- Вакцини та анатоксини, що містять кілька компонентів і використовуються для профілактики декількох інфекційних захворювань, називаються багатокомпонентними.
Вакцини можуть бути живі, інактивовані та отримані за допомогою технології рекомбінантної ДНК.
Інші терміни вживаються в цьому Порядку відповідно до Порядку забезпечення належних умов зберігання, транспортування, приймання та обліку вакцин, анатоксинів та алергену туберкульозного в Україні, затвердженого цим наказом.
II. Умови поставки та зберігання вакцин та анатоксинів в аптечних закладах
1. Доставка вакцин та анатоксинів зі складу в аптечний заклад здійснюється з дотриманням «холодового ланцюга» відповідно до Порядку забезпечення належних умов зберігання, транспортування, приймання та обліку вакцин, анатоксинів та алергену туберкульозного в Україні, затвердженого цим наказом.
2. Вимоги до приміщення:
2.1. Для зберігання вакцин та анатоксинів виділяється окремий холодильник з достатнім корисним об’ємом, призначений для зберігання тільки вакцин та анатоксинів.
2.2. У приміщенні передбачаються опалення, вентиляція, підводка води з установкою раковини.
2.3. Освітленість робочих поверхонь здійснюється люмінесцентними лампами.
2.4. Стіни і підлога повинні бути покриті матеріалами, що витримують вологе прибирання і дезінфекцію.
2.5. Приміщення обладнується холодильниками з морозильними відсіками, робочим столом, термоконтейнером достатньої ємності, холодоелементами, контейнером для сміття, ємністю для приготування дезінфекційного розчину.
3. Зберігання вакцин та анатоксинів здійснюється в холодильнику при температурі від 2 до 8 °C з достатнім корисним об’ємом, призначеним тільки для зберігання вакцин. Зберігання в ньому інших предметів або препаратів не допускається. У морозильній камері зберігаються холодоелементи. Холодильник обладнується термометром та за можливості датчиком температури.
Для зберігання вакцин та анатоксинів виділяють окремий холодильник, у разі невеликого об’єму вакцини можливе зберігання різних вакцин та анатоксинів в одному холодильнику на різних маркованих полицях. Розчинник до вакцин та анатоксинів також зберігають у холодильниках.
4. Забороняється зберігання вакцин та анатоксинів у дверній панелі холодильника.
5. Контроль за температурним режимом зберігання вакцин та анатоксинів здійснюється двічі на добу. Покази термометра та/або датчика температури заносяться до журналу реєстрації температури в холодильнику (додаток 1) (далі — Журнал).
6. При аварійному чи плановому відключенні холодильника вакцини та анатоксини зберігаються в термоконтейнерах із холодоелементами.
7. Факти аварійного чи планового відключення холодильника фіксуються в Журналі.
8. Вакцини та анатоксини, що зберігались в умовах порушення «холодового ланцюга», не можуть бути використані і підлягають знищенню.
III. Облік вакцин та анатоксинів
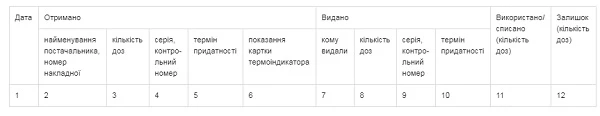
1. Облік вакцин та анатоксинів в аптечному закладі ведеться у спеціальному журналі обліку та використання вакцин та анатоксинів (додаток 2). У цьому журналі зазначаються дата надходження/видачі вакцин та анатоксинів, торговельна назва вакцин та анатоксинів, форма випуску, найменування підприємства та країни-виробника, серія, номер і кількість доз.
2. В аптечному закладі, що здійснює торгівлю вакцинами та анатоксинами, повинні бути наявні такі документи:
- журнал обліку і руху вакцин та анатоксинів;
- копії накладних на придбання вакцин та анатоксинів;
- акти перевірки умов зберігання, обліку і видачі вакцин та анатоксинів, видані фахівцями санітарно-епідеміологічної служби;
- акти на списання вакцин та анатоксинів;
- інструкції про застосування вакцин та анатоксинів.
IV. Умови продажу вакцин та анатоксинів
1. Продаж вакцин та анатоксинів в аптечних закладах здійснюється за рецептом лікаря лікувально-профілактичного закладу (незалежно від форм власності).
2. Продаж вакцин та анатоксинів покупцю проводиться за наявності у нього термоконтейнера з холодоелементами.
3. Покупцю видається відповідна до рецепта кількість доз вакцин та анатоксинів в упаковці; кожна доза вакцини супроводжується інструкцією про застосування вакцин та анатоксинів українською мовою та розрахунковим документом з датою та годиною продажу.
4. Відповідальний за продаж вакцин та анатоксинів працівник зобов’язаний пояснити покупцю умови зберігання вакцини та анатоксинів і необхідність проведення вакцинації в лікувально-профілактичному закладі.
5. Придбана вакцина та анатоксини дозволені до застосування в кабінетах щеплення лікувально-профілактичних закладів при суворому дотриманні умов зберігання і санітарно-гігієнічних вимог.
V. Порядок списання і знищення вакцин та анатоксинів у аптечній мережі
1. Списанню та знищенню підлягають вакцини та анатоксини:
- із закінченим терміном придатності;
- які зберігались із порушенням «холодового ланцюга»;
- із зовнішніми властивостями, що змінилися, які не визначені в інструкції про застосування даної вакцини (наявність осаду, сторонніх предметів, зміна кольору і прозорості).
2. В аптечних закладах для списання вакцин та анатоксинів, не придатних до застосування, створюється комісія у складі трьох осіб із медичною або фармацевтичною освітою.
3. Комісія складає акт списання і знищення вакцин та анатоксинів (додаток 3).
4. Знищення вакцин та анатоксинів проводиться у тому самому приміщенні, де вони зберігаються.
5. Правила знищення вакцин та анатоксинів:
5.1. Ампули і флакони з інактивованими і рекомбінантними вакцинами та анатоксинами розкриваються, виливаються в раковину, скло викидається в ємність для сміття без додаткового знезаражування.
5.2. Ампули і флакони з живими вакцинами після розкриття вкладають у дезінфекційний розчин на одну годину або на інший строк, визначений в інструкції про застосування дезінфекційних засобів, потім виливають у раковину, скло викидають у ємність для сміття.
VI. Умови техніки безпеки
1. У разі ушкодження ємності, що містить вакцину чи анатоксин, знищення вакцин, анатоксинів проводиться у порядку, встановленому підпунктами 5.1 та 5.2 пункту 5 розділу V цього Порядку.
2. При потраплянні вакцин чи анатоксинів на слизову оболонку очей їх промивають великою кількістю води.
3. У разі ушкодження шкірних покривів рани обробляють спиртовим розчином йоду.
4. Меблі, ділянки підлоги, забруднені вакциною, обробляють 3% розчином хлораміну.
5. При збиранні часток скла необхідно користуватись щітками, пінцетом і совком. Забороняється збирати бите скло руками і ганчірками.
Директор Департаменту охорони
материнства, дитинства та
санаторного забезпечення С. І. ОСТАШКО
Начальник Управління громадського
здоров’я та санітарно-епідемічного
благополуччя населення А. А. ГРИГОРЕНКО
Додаток 1
до Порядку відпуску громадянам
вакцин та анатоксинів через аптечну мережу
ЖУРНАЛ РЕЄСТРАЦІЇ ТЕМПЕРАТУРИ В ХОЛОДИЛЬНИКУ в ____ році

Додаток 2
до Порядку відпуску громадянам вакцин та анатоксинів
через аптечну мережу
ЖУРНАЛ
ОБЛІКУ ТА ВИКОРИСТАННЯ ВАКЦИН ТА АНАТОКСИНІВ
у ______________________________
(найменування аптечного закладу)
__________________________________________________________
(торговельна назва вакцини, найменування країни та підприємства-виробника)
Додаток 3
до Порядку відпуску громадянам вакцин та анатоксинів
через аптечну мережу
АКТ СПИСАННЯ І ЗНИЩЕННЯ ВАКЦИН ТА АНАТОКСИНІВ
ЗАТВЕРДЖУЮ
____________________________________
(П. І. Б. керівника аптечного закладу)
____________________________________
«___» ____________ 20__ року
АКТ
м. _____________ ____________ 20__ року
Цей акт складений комісією у складі _________________________________________
(П. І. Б., посади)
_____________________________________________________________________
У зв’язку з_____________________________________________________________
(вказати причину списання)
перевірено списання і знищення таких видів вакцин та анатоксинів:
1.____________________________________________________________________
(торговельна назва вакцини чи анатоксину, найменування підприємства-виробника, серія,
контрольний номер, термін придатності, кількість доз)
2.____________________________________________________________________
(торговельна назва вакцини, найменування підприємства-виробника, серія, контрольний номер,
термін придатності, кількість доз)
Усі перераховані препарати знищені шляхом (указати): _______________________________________________________________________________________________
Члени комісії: _______________________ _______________________
(П. І. Б., посада) (підпис)
_______________________ _______________________
(П. І. Б., посада) (підпис)
_______________________ _______________________
(П. І. Б., посада) (підпис)
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
16.09.2011 № 595
Зареєстровано
в Міністерстві юстиції України
10 жовтня 2011 р.
за № 1166/19904
ПОРЯДОК
забезпечення належних умов зберігання, транспортування, приймання
та обліку вакцин, анатоксинів та алергену туберкульозного в Україні
I. Загальні положення
1. Цей Порядок установлює належні умови зберігання, транспортування, приймання та обліку вакцин, анатоксинів та алергену туберкульозного, що потребують особливих температурних умов (далі — «холодовий ланцюг»).
2. Цей Порядок поширюються на всі вакцини, анатоксини та алерген туберкульозний, які потребують умов дотримання «холодового ланцюга», що ввозяться або виробляються в Україні суб’єктами господарювання незалежно від підпорядкування та форм власності.
«Холодовий ланцюг» — безперервно функціонуюча система, що забезпечує оптимальний температурний режим зберігання і транспортування на всіх етапах переміщення вакцин, анатоксинів та алергену туберкульозного від підприємства-виробника до споживача.
3. Дотримання належних умов зберігання і транспортування вакцин, анатоксинів та алергену туберкульозного є необхідною та обов’язковою умовою збереження показників якості (ефективності та безпечності), визначених та затверджених сертифікатом якості, який надається підприємством-виробником. Контроль за дотриманням умов «холодового ланцюга» здійснюється відповідно до цього Порядку Департаментом імунобіологічних препаратів та імунопрофілактики державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» спільно з територіальними закладами державної санітарно-епідеміологічної служби України.
4. Вакцини, анатоксини та алерген туберкульозний повинні зберігатися та транспортуватися з дотриманням відповідних температурних умов «холодового ланцюга», визначених в інструкціях про їх застосування.
5. Зберігання препаратів за умови підвищеної температури призводить до зменшення вмісту життєздатних мікробних клітин у живих бактеріальних та вірусних вакцинах.
Заморожування сорбованих препаратів призводить до десорбції антигенів, що викликає значне зниження їх імуногенності, порушення фізико-хімічної структури білків, падіння активності діючої речовини.
Недотримання умов зберігання та транспортування може призвести не лише до зниження лікувально-профілактичних властивостей вакцин та анатоксинів, а й до виникнення непередбачених побічних та неспецифічних проявів.
6. При визначенні режиму зберігання і транспортування вакцин, анатоксинів та алергену туберкульозного необхідно керуватися інструкціями про їх застосування.
7. Оптимальною для зберігання і транспортування вакцин, анатоксинів та алергену туберкульозного є температура у межах від +2 до +8 °C.
Зберігання пероральної вакцини для профілактики поліомієліту рекомендується відповідно до інструкції про її застосування в замороженому стані при температурі від –15 до –25 °C. При зберіганні та транспортуванні вакцини в температурному режимі від +2 до +8 °C термін придатності зазначеної вакцини 6 місяців.
8. Категорично не допускається заморожування адсорбованих вакцин, вакцини проти гепатиту B, розчинників для ліофілізованих вакцин.
9. Вакцини повинні зберігатись у захищеному від світла місці.
10. Ліофілізовані вакцини повинні використовуватися разом з розчинником одного виробника.
II. Структура «холодового ланцюга»
1. Основними складовими «холодового ланцюга» є наявність:
- спеціально підготовленого персоналу, що забезпечує обслуговування холодильного обладнання, зберігання та постачання вакцин, анатоксинів та алергену туберкульозного до закладів охорони здоров’я України;
- холодильного обладнання, транспортних засобів, що забезпечують належні умови для зберігання та транспортування вакцин, анатоксинів та алергену туберкульозного;
- проведення контролю за дотриманням необхідного температурного режиму на всіх його етапах.
- 2. Система «холодового ланцюга» складається з таких рівнів:
- 1-й — підприємство-виробник вакцини, анатоксину та алергену туберкульозного;
- 2-й — склади оптового зберігання вакцин, анатоксинів та алергену туберкульозного (регіональні);
- 3-й — районні і міські заклади охорони здоров’я (територіальні);
- 4-й — кабінети щеплень лікувально-профілактичних закладів (дільничні лікарні, амбулаторії, дитячі поліклініки, пологові будинки тощо).
3. На всіх рівнях «холодового ланцюга» обов’язково проводиться реєстрація в журналах обліку отримання, умов зберігання і подальшого переміщення вакцин, анатоксинів та алергену туберкульозного споживачу з обов’язковою реєстрацією вакцини, анатоксину та алергену туберкульозного за торговельною назвою, кількістю доз, номером серії, терміном придатності, дат отримання, умов зберігання та транспортування, показів карток-індикаторів, індикаторів заморожування та показників реєструючих приладів (термореєстратори, термотестери) із зазначенням прізвища відповідальної особи.
Показники термотестерів, термореєстраторів та термографів у вигляді температурних графіків і таблиць зберігають разом з журналом реєстрації температури для подальшої звітності.
4. На всіх рівнях «холодового ланцюга» повинні працювати призначені керівником установи спеціалісти з чітко визначеними посадовими обов’язками відповідно до займаної посади.
У системі «холодового ланцюга» використовують таке обладнання: холодильні кімнати (камери), морозильні камери, морозильники, побутові холодильники, термоконтейнери, медичні сумки-холодильники, холодоелементи, термоіндикатори, термореєстратори, термометри, термографи та термотестери.
III. Обладнання «холодового ланцюга»
1. Холодильні кімнати (камери) використовуються для зберігання та пакування вакцин, анатоксинів та алергену туберкульозного. Завантаження холодильної кімнати повинно забезпечувати вільну циркуляцію повітря по всьому об’єму кімнати (камери).
2. Морозильні камери використовують для вакцин, зберігання яких згідно з інструкцією про застосування повинно відбуватися в замороженому стані, а також для заморожування та зберігання холодоелементів.
3. Морозильники використовують для заморожування холодоелементів.
4. Побутові холодильники використовують для зберігання вакцин, анатоксинів та алергену туберкульозного на 3-му та 4-му рівнях «холодового ланцюга».
5. Термоконтейнер — ємність різних розмірів з термоізолюючого матеріалу, яка герметично закривається кришкою. Термоконтейнери ємністю понад 10 дм3 повинні забезпечувати температурний режим зберігання та транспортування від +2 до +8 °C не менше 48 годин при постійному впливі навколишнього середовища +43 °C та від +8 до +2 °C не менше 10 годин при постійному впливі температури навколишнього середовища – 30 °C. Термоконтейнери ємністю менше 10 дм3 повинні забезпечувати температурний режим зберігання та транспортування вакцин, анатоксинів та алергену туберкульозного від +2 до +8 °C не менше 24 годин при постійному впливі температури навколишнього середовища +43 °C та від +8 до +2 °C не менше 10 годин при постійному впливі температури навколишнього середовища –20 °C.
6. Медична сумка-холодильник повинна забезпечувати температурний режим від +2 до +8 °C. Внутрішня поверхня сумки має бути вкрита матеріалом, що дозволяє проводити дезінфекцію.
7. Холодоелемент — ємність з герметично закритою пробкою, яка заповнюється водою або спеціальною рідиною. Для транспортування вакцин, анатоксинів та алергену туберкульозного упродовж 1 години холодоелемент попередньо протягом не менше 1–3-х годин зберігається в холодильнику (температура холодоелемента повинна становити від +2 до +8 °C). Якщо час транспортування вакцин, анатоксинів та алергену туберкульозного буде тривати понад 1 годину, холодоелемент заморожують у морозильній камері (температура холодоелемента повинна становити від –18 до –20 °C). При перенесенні вакцин, анатоксинів та алергену туберкульозного у термоконтейнери для транспортування холодоелемент кондиціюють. Для запобігання прямому контакту вакцин, анатоксинів та алергену туберкульозного з холодоелементами між ними розміщується термоізолюючий матеріал (повітряні пакети, картон, пінопласт). Оптимальна температура транспортування вакцин, анатоксинів та алергену туберкульозного від +2 до +8 °C.
При визначенні особливостей транспортування кожної вакцини, анатоксину та алергену туберкульозного необхідно враховувати вимоги інструкцій про їх застосування.
8. Термоіндикатори:
8.1. Контрольна картка-індикатор (далі — картка-індикатор) — це часовий інтегратор температури, що застосовується для моніторингу температури та фіксації температурного впливу на препарат. Картка-індикатор має чотири термочутливі віконця-індикатори (A, B, C, D), місце для запису інформації про вакцини, анатоксини та алерген туберкульозний — торговельної назви, найменування підприємства-виробника, дати відправлення, дати отримання та видачі препарату, найменування закладу охорони здоров’я, показів віконець-індикаторів. Віконця поступово реагують на підвищення температури, змінюючи колір з білого на блакитний. Картка-індикатор містить інструкцію про використання та таблицю, що пояснює покази віконець-індикаторів.
8.2. Індикатор заморожування (далі — індикатор) — засіб контролю, що застосовується для контролю за температурним режимом транспортування і зберігання вакцин, анатоксинів та алергену туберкульозного, чутливих до заморожування. Індикатор містить капсулу з фарбувальним розчином, яка руйнується, якщо більше години температура становила 0 °C.
8.3. Електронний індикатор заморожування «Freez-teg», який контролює температуру навколишнього середовища та показує на дисплеї факт впливу температури нижче 0 °C протягом 10 хвилин.
Термореєстратори забезпечують контроль температурного режиму на всіх рівнях «холодового ланцюга» при зберіганні та транспортуванні вакцин, анатоксинів та алергену туберкульозного.
9. Термограф — прилад для безперервної реєстрації температури в холодильному обладнанні.
10. Термометри використовують для контролю температурного режиму при зберіганні вакцин, анатоксинів та алергену туберкульозного. Термометри повинні бути сертифіковані та повірені.
11. Термотестер — електронний пристрій багаторазового застосування для незалежного контролю температури з можливістю документування отриманих даних в електронному, паперовому або іншому вигляді. Робочий діапазон температур від –30 °C до +50 °C та часовою дискретністю проведення вимірювань температури — від 1 до 60 хвилин залежно від попереднього регулювання. Термотестер має етикетку з інформацією про дату виготовлення та серійний номер, який повинен збігатися з номером, зафіксованим у «пам’яті» даного пристрою. Використовуються тільки термотестери, що пройшли повірку відповідно до вимог чинного законодавства.
IV. Вимоги до зберігання вакцин, анатоксинів та алергену туберкульозного
1. При зберіганні вакцин, анатоксинів та алергену туберкульозного необхідно дотримуватись таких загальних правил:
- вакцини, анатоксини та алерген туберкульозний зберігають при температурі, вказаній в інструкціях про їх застосування;
- розчинники для вакцин необхідно зберігати при температурі від +2 до +8 °C з метою запобігання підвищенню температури вакцини при її розчиненні;
- вакцини, які вимагають зберігання в замороженому стані, повинні зберігатися в морозильних камерах при температурі від –15 до –25 °C для 1–2-го рівнів системи «холодового ланцюга»;
- вакцини, анатоксини та алерген туберкульозний повинні бути розміщені таким чином, щоб до кожної упаковки був доступ охолодженого повітря;
- вакцини, анатоксини та алерген туберкульозний повинні бути розміщені таким чином, щоб препарат, який має менший термін придатності, використовувався в першу чергу.
2. Для зберігання вакцин, анатоксинів та алергену туберкульозного використовують морозильні і холодильні камери, холодильні шафи.
3. Загальний об’єм холодильного обладнання 1-го рівня системи «холодового ланцюга» залежить від кількості вакцин, анатоксинів та алергену туберкульозного. Вакцини, анатоксини та алерген туберкульозний зберігають згідно з інструкціями про їх застосування в холодильних або морозильних камерах. Пакування вакцин, анатоксинів та алергену туберкульозного в термоконтейнери для транспортування здійснюють у холодильних кімнатах (камерах).
4. Холодильне обладнання, призначене для зберігання вакцин, анатоксинів та алергену туберкульозного, повинно використовуватися тільки за призначенням. Сумісне зберігання вакцин, анатоксинів та алергену туберкульозного з іншими лікарськими засобами та сторонніми матеріалами, а також зберігання вакцин, анатоксинів та алергену туберкульозного у дверях холодильників є недопустимим.
5. Для наступних рівнів «холодового ланцюга» (2–4-й рівні системи «холодового ланцюга») загальний об’єм холодильного обладнання повинен забезпечувати належне зберігання всієї кількості вакцин, анатоксинів та алергену туберкульозного, що перебувають на даному рівні. Розрахунок об’єму зберігання проводять за показниками співвідношення геометрії упаковки препарату (об’єм упаковки в см3) до загального об’єму холодильного обладнання.
6. На всіх рівнях «холодового ланцюга» повинен бути затверджений керівником закладу план екстрених заходів на випадок виникнення аварійних ситуацій порушення «холодового ланцюга».
V. Вимоги до транспортування вакцин, анатоксинів та алергену туберкульозного
1. Транспортування вакцин, анатоксинів та алергену туберкульозного повинно здійснюватися у термоконтейнерах разом з відповідними картками-індикаторами, індикаторами заморожування та термотестерами рефрижераторним транспортом при температурі від +2 до +8 °C.
2. Завантаження препаратів у термоконтейнери здійснюється в холодильній камері (приміщенні для зберігання вакцин, анатоксинів та алергену туберкульозного). У виключних випадках завантаження може здійснюватися при кімнатній температурі в термін, що не перевищує 10 хвилин.
Холодоелементи кондиціюють до появи в них рідини та вільного переміщення льоду всередині. У термоконтейнері повинні бути засоби контролю за температурним режимом.
3. Термоконтейнери, які призначені для транспортування вакцин, анатоксинів та алергену туберкульозного, повинні бути справні і можуть використовуватись багаторазово.
4. Підприємство-виробник та склади оптового зберігання вакцин, анатоксинів та алергену туберкульозного повинні мати достатню кількість термоконтейнерів, холодоелементів, карток-індикаторів, індикаторів заморожування та термотестерів для забезпечення контролю за належними умовами транспортування вакцин, анатоксинів та алергену туберкульозного споживачам.
5. Термоконтейнер поміщають у картонну коробку, яка запобігає його псуванню. На коробку наносять етикетку з написами «Вакцина! Терміновий вантаж», «Не заморожувати!» для вакцин, анатоксинів та алергену туберкульозного, заморожування яких недопустимо.
6. Підприємство-виробник та склади оптового зберігання вакцин, анатоксинів та алергену туберкульозного (1-й та 2-й рівні системи «холодового ланцюга») обов’язково повинні забезпечити транспортування вакцин, анатоксинів та алергену туберкульозного з дотриманням «холодового ланцюга». З цією метою підприємство-виробник та склади оптового зберігання повинні мати рефрижераторний транспорт.
7. При отриманні вакцини, анатоксини та алерген туберкульозний негайно розміщують у холодильному обладнанні, перевіряючи покази контролюючих засобів.
8. На 2-му рівні «холодового ланцюга» відповідальна особа повинна мати узгоджений графік постачання вакцин, анатоксинів та алергену туберкульозного на 3-й рівень та контролювати терміни придатності вакцин, анатоксинів та алергену туберкульозного, не допускаючи їх відвантаження з терміном придатності менше одного місяця.
9. Транспортування вакцин, анатоксинів та алергену туберкульозного до лікувально-профілактичних закладів (3-й та 4-й рівні системи «холодового ланцюга») здійснюється в термоконтейнерах. Зберігання вакцин, анатоксинів та алергену туберкульозного у лікувально-профілактичних закладах є аналогічним зберіганню вакцин, анатоксинів та алергену туберкульозного на 1-му та 2-му рівнях.
VI. Контроль за дотриманням умов «холодового ланцюга»
1. Контроль за дотриманням умов «холодового ланцюга» проводиться за показами реєструючих приладів стаціонарного холодильного обладнання і рефрижераторного транспорту, карток-індикаторів, температурних індикаторів, індикаторів заморожування, термотестерів та записів у Журналі реєстрації температури, форма якого наведена у додатку 1 до Порядку відпуску громадянам вакцин та анатоксинів через аптечну мережу, затвердженому цим наказом. Реєстрація температури проводиться двічі на добу та засвідчується підписом відповідальної особи.
2. Посадові особи, відповідальні за зберігання, транспортування та використання вакцин, анатоксинів та алергену туберкульозного, зобов’язані проводити регулярний контроль дотримання належних умов «холодового ланцюга».
3. Для контролю умов транспортування вакцин, анатоксинів та алергену туберкульозного кожна транспортна тара повинна бути забезпечена необхідними контролюючими засобами, враховуючи термотестер. Картки-індикатори та індикатори заморожування розміщують у нижній та верхній частинах транспортної тари. Термоіндикатори повинні зберігатись разом з партією вакцини, анатоксину та алергену туберкульозного, з якою вони надійшли.
4. З метою постійного моніторингу забезпечення належних температурних умов транспортування та зберігання медичних імунобіологічних препаратів відповідальні особи на кожному рівні системи «холодового ланцюга» звітують один раз на квартал перед територіальними закладами державної санітарно-епідеміологічної служби.
При виникненні аварійних ситуацій на всіх рівнях «холодового ланцюга» необхідно негайно інформувати територіальні заклади державної санітарно-епідеміологічної служби, а Департамент імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України» — у 24-годинний строк.
VII. Правила приймання вакцин, анатоксинів та алергену туберкульозного
1. Отримувач вакцин, анатоксинів та алергену туберкульозного повинен бути заздалегідь (не менше ніж за дві доби) проінформований про прибуття вакцин, анатоксинів та алергену туберкульозного до пункту призначення. Інформація має містити дані про найменування вакцин, анатоксинів та алергену туберкульозного, форму випуску, їх кількість, серію, дату прибуття.
2. У місці прибуття вакцин, анатоксинів та алергену туберкульозного повинні бути створені умови для їх зберігання відповідно до вимог «холодового ланцюга» та інструкцій про їх застосування.
3. При отриманні вакцин, анатоксинів та алергену туберкульозного у місці призначення їх необхідно терміново помістити до холодильного обладнання. При цьому отримувачем обов’язково повинні перевірятися показники карток-індикаторів, індикаторів заморожування та термотестерів. На цьому етапі за якість та кількість вакцин, анатоксинів та алергену туберкульозного є відповідальним отримувач.
4. При порушенні вимог «холодового ланцюга» (на будь-якому етапі) отримувач має право вимагати складання відповідного акта і/або відмовитися від отримання вакцин, анатоксинів та алергену туберкульозного (у разі порушення режиму зберігання або транспортування) або у разі виникнення сумнівів стосовно якості вакцин, анатоксинів та алергену туберкульозного вимагати перевірку їх якості.
5. Про всі випадки порушення умов «холодового ланцюга» отримувач сповіщає Департамент імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України» та територіальні заклади державної санітарно-епідеміологічної служби.
Вакцини, анатоксини та алерген туберкульозний повинні бути вилучені з обігу в разі:
- порушення умов транспортування;
- порушення умов зберігання;
- порушення якості упаковки;
- зміни фізичних властивостей вакцин, анатоксинів;
- закінчення терміну придатності.
Представник підприємства-постачальника повинен брати участь у процесі прийняття рішення отримувачем про вилучення з обігу або повернення товару на склад.
6. Дотримання належного режиму зберігання контролюють працівники, які здійснюють цю функцію згідно з посадовими інструкціями.
Форма акта приймання-передавання вакцин, анатоксинів та алергену туберкульозного наведена в додатку до цього Порядку.
VIII. Правила обліку вакцин, анатоксинів та алергену туберкульозного
1. На всіх рівнях «холодового ланцюга» повинен бути забезпечений повний і регулярний облік вакцин і розчинників, анатоксинів та алергену туберкульозного, що зберігаються.
2. Відомості щодо кожної вакцини, анатоксину та алергену туберкульозного повинні містити щонайменше:
торговельну назву вакцини, анатоксину та алергену туберкульозного, форму випуску, номер серії, термін придатності, кількість доз, найменування й місцезнаходження підприємства-виробника, найменування та місцезнаходження постачальника, кількість отриманих та кількість відправлених (використаних) вакцин, анатоксинів та алергену туберкульозного, кількість отриманого та відправленого (використаного) розчинника, залишок препаратів після відправлення, дату отримання та відправлення (використання) кожної вакцини, анатоксину та алергену туберкульозного.
3. Установи (1–3-го рівнів системи «холодового ланцюга») повинні мати затверджений керівником установи план екстрених заходів з вилучення відправленої продукції та надання вичерпної інформації Департаменту імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України» про розподіл вакцин, анатоксинів та алергену туберкульозного.
Директор Департаменту охорони
материнства, дитинства
та санаторного забезпечення С. І. ОСТАШКО
Начальник Управління громадського
здоров’я та санітарно-епідемічного
благополуччя населення А. А. ГРИГОРЕНКО
Додаток
до Порядку забезпечення
належних умов зберігання, транспортування, приймання та обліку вакцин, анатоксинів та алергену туберкульозного в Україні
ФОРМА АКТА ПРИЙМАННЯ-ПЕРЕДАВАННЯ ВАКЦИН,
АНАТОКСИНІВ ТА АЛЕРГЕНУ ТУБЕРКУЛЬОЗНОГО
Торговельна назва вакцин, анатоксину,
алергену туберкульозного, форма випуску __________________________________
_________________________________________________________________
Номер серії ________________________________________________________
Термін придатності __________________________________________________
Найменування й місцезнаходження підприємства-виробника
_________________________________________________________________
_________________________________________________________________
Найменування й місцезнаходження постачальника ___________________________
_________________________________________________________________
Найменування й місцезнаходження перевізника _____________________________
_________________________________________________________________
Кількість товару за документами (у дозах) __________________________________
_________________________________________________________________
Кількість товару, отримана фактично (у дозах) _______________________________
_________________________________________________________________
Цілісність упаковки (порушена/не порушена) ____________________________
(Якщо виявлено порушення, указати кількість порушених упаковок) _______________
Кількість карток-індикаторів ___________________________________________
Показники карток-індикаторів __________________________________________
Висновок _________________________________________________________
_________________________________________________________________
Дата/час складання акта _______________________________________________
Представник одержувача ________ (П.І.Б.) _________ (посада) _________________
Представник постачальника/перевізника _______ (П. І. Б.) ________ (посада) _______
Підписи/печатки


